| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
- non-parametric model
- 파이썬
- deep learning #segmentation #sementic #pytorch #UNETR #transformer #UNET #3D #3D medical image
- TabNet
- 모수적 모델
- parer review
- paper review
- 데코레이터
- 확산텐서영상
- nfiti
- nibabel
- 확산강조영상
- 비모수적 모델
- parrec
- MRI
- TeCNO
- nlp
- monai
- parametric model
- decorater
- precision #정밀도 #민감도 #sensitivity #특이도 #specifisity #F1 score #dice score #confusion matrix #recall #PR-AUC #ROC-AUC #PR curve #ROC curve #NPV #PPV
- MICCAI
- 코드오류
- Phase recognition
- PYTHON
- 유전역학
- genetic epidemiology
- tabular
- words encoding
- Surgical video analysis
- Today
- Total
KimbgAI
[medical] 유전역학-개론, 8주차 암 유전체 연구 본문
암은 원칙적으로 유전학에서 정의하는 inheritance trait이 아니기 때문에 일반적인 유전학 범위에는 들어가진 않는다.

오늘 배울 것은 위와 같다.
종양이란 무엇이고, 셀 사이클이라는 개념이 나오는데 이건 무엇이고, 암은 inherited하지 않은데 어째서 genetic하다는 것인지?, driver & passenger mutation이 무엇인지 등등..

cancer에 정의에 앞서 먼저 tumor에 대한 정의가 필요하다.
모든 cell은 stem cell에서 시작하고 각각의 기능에 맞는 specialized cell이 되도록 분화된다.
tumor라고 하는것은 이런 specialized cell이 되는 일련의 과정 속에 어떤 문제가 생겨서 그 단계에 도달하지 못하는 상태, 또는 그 상태에서 비정상적으로 증식한 상태를 의미한다.
또한 tumor는 양성과 악성 두가지를 모두 포함하는 것이고, 그럼 어떨때 cancer냐 하면 invasion 또는 주변으로 퍼지는 특성을 가진 셀로 바뀌었을때 cancerous 또는 malignant tumor 라고 한다.

Matastasis는 한국말로 '전이'라고 하며, 이 종양이 다른 쪽으로 전이되는 상태를 의미한다.
이 tumor cell은 혈관 또는 림프관을 타고 다른 곳으로 이동할 수가 있다.
이런 경우 매우 치명적일 수 있다. 왜냐하면 우리가 탐지할 수 없는 곳에서 전이가 될 수 있기 때문이며, 타겟 조직에서는 효과가 있었던 약물이 다른 조직으로 전이된 곳에서는 작동하지 않을 수 있기 때문.
Carcinogen이라고 하는것은 cancer을 일으키는 어떤 물질을 의미하고, 일반적으로는 DNA를 손상시키는 물질인 경우가 많다. 또는 Mutagen이라고도 한다.
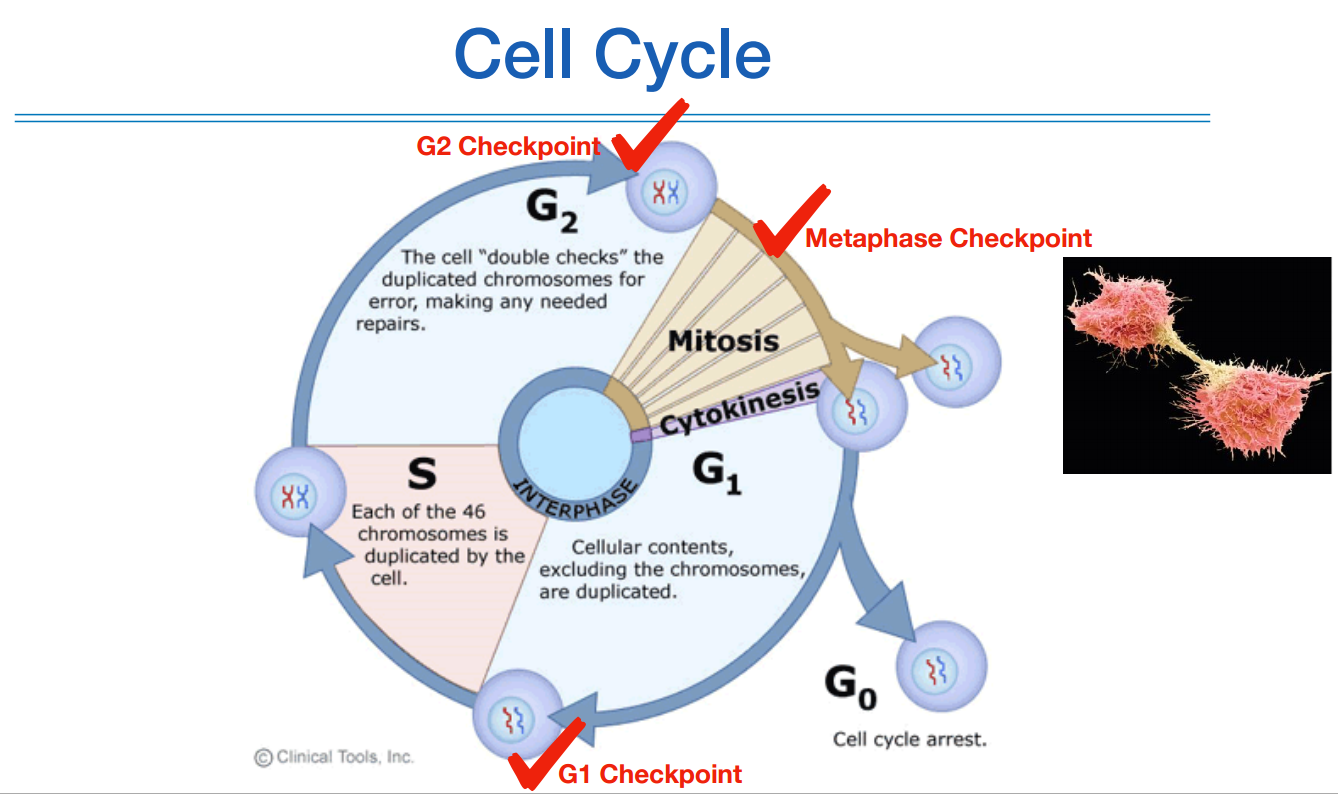
대부분의 cancer가 나타나는 원인이 이 cell cycle에 문제가 있어서 나타난다. 그리하여 이 cell cycle의 메카니즘을 이해를 해야 cancer genomics에 대해 이해할 수 있다.
셀 사이클은 세포가 분열하는 과정을 의미하며, 생식세포 분열 단계가 아니고 체세포 분열을 의미한다.
셀 사이클은 분열을 위한 준비단계와 분열 단계 이렇게 크게 두가지 단계로 나눌 수 있다.
준비단계를 inter phase라고 하고 (위 그림에서 G1, S, G2 영역), 분열단계를 Mitosis 라고 한다.
스타트는 딸세포 하나에서부터 시작한다. Cytokinesis 상태.
생식세포가 아니라 체세포이기 때문에 2n(Sister chromatids)이 아니라 n(chromatids) 상태, homologous chromosome 상태이다. Sister chromatids 형태는 아직 아니다.
G1 단계는 DNA를 제외한 나머지 organic 들이 증폭하는 단계이다. 분열하기 위해서는 어느정도 영양분이 확보가 되어야 하기 때문에. 따라서 G1이 끝나도 DNA양은 동일하다.
S 단계에서는 sister chromatid가 되어 DNA양이 두배로 들어난다.
G2는 DNA 복제가 제대로 되었는지 체크하는 단계이다.
정상적으로 체크가 잘 되었으면 Mitosis에 들어간다.
한 세포가 두개로 나뉜 상태를 Cytokinesis 상태라고 한다.
무한정 분열을 할 수는 없기 때문에, 보통 한 사이클이 끝나면 G0상태인 대기상태로 들어간다.
필요할때가 되면 G1 상태로 들어간다. 한번 G1 상태로 들어간 셀은 되돌릴 수 없다. 무조건 분열을 해야만한다.
cancer는 이 사이클이 무한정 돌게 된다.
이러한 경우를 예방하기 위해 각 단계마다 checkpoint가 있다.
G1 단계에서는 지금 가지고 있는 재료가 정상적인지, 복제하기 위한 충분한 영양분이 있는지 체크한다. 만약에 비정상적인 상태로 체크가 되면 repair가 되거나 폐기가 된다.
G2 단계에서는 DNA 복제단계에서의 에러 여부를 체크하고, 분열할 준비가 되었는지 체크한다.
Metaphase 단계에서도 분열이 일어나는 과정에서 발생하는 문제를 체크하고 잘못된 셀은 사멸시키거나 처리한다.
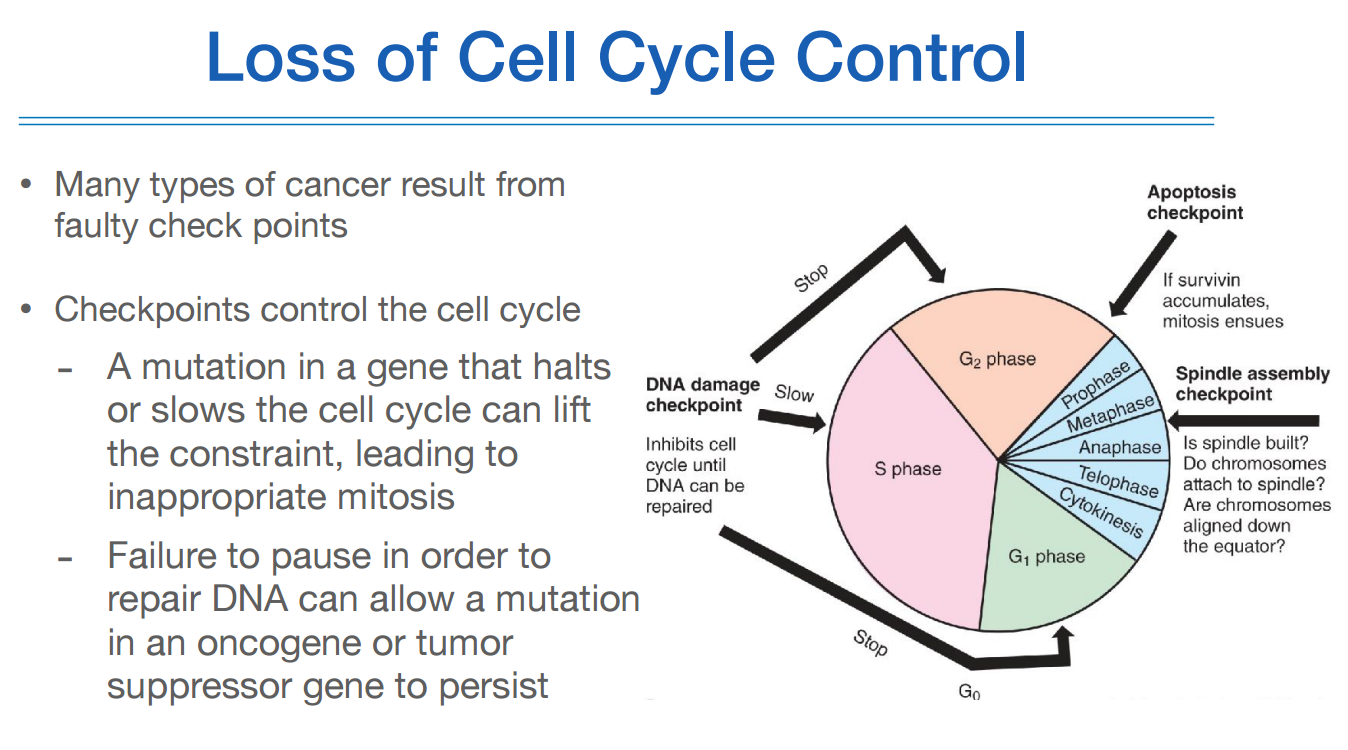
셀 사이클에 체크포인트가 있다는 사실을 발견함으로 인해서 cancer의 기전을 알게되었고, 이런 체크포인트에 관여하는 유전자에 변이가 생기면 체크를 제대로 할 수 없으니 이상한 애들이 다음 phase로 넘어가 문제를 발생시킨다.
혹은 체크가 잘 되었더라도 잘못된 애들을 repair하거나 처리하는 애들에 변이가 있으면 문제가 발생할 수 있다.
이런 체크포인트에 관여하는 유전자의 변이가 genetic 측면에서는 cancer를 일으키는 원인이 된다.
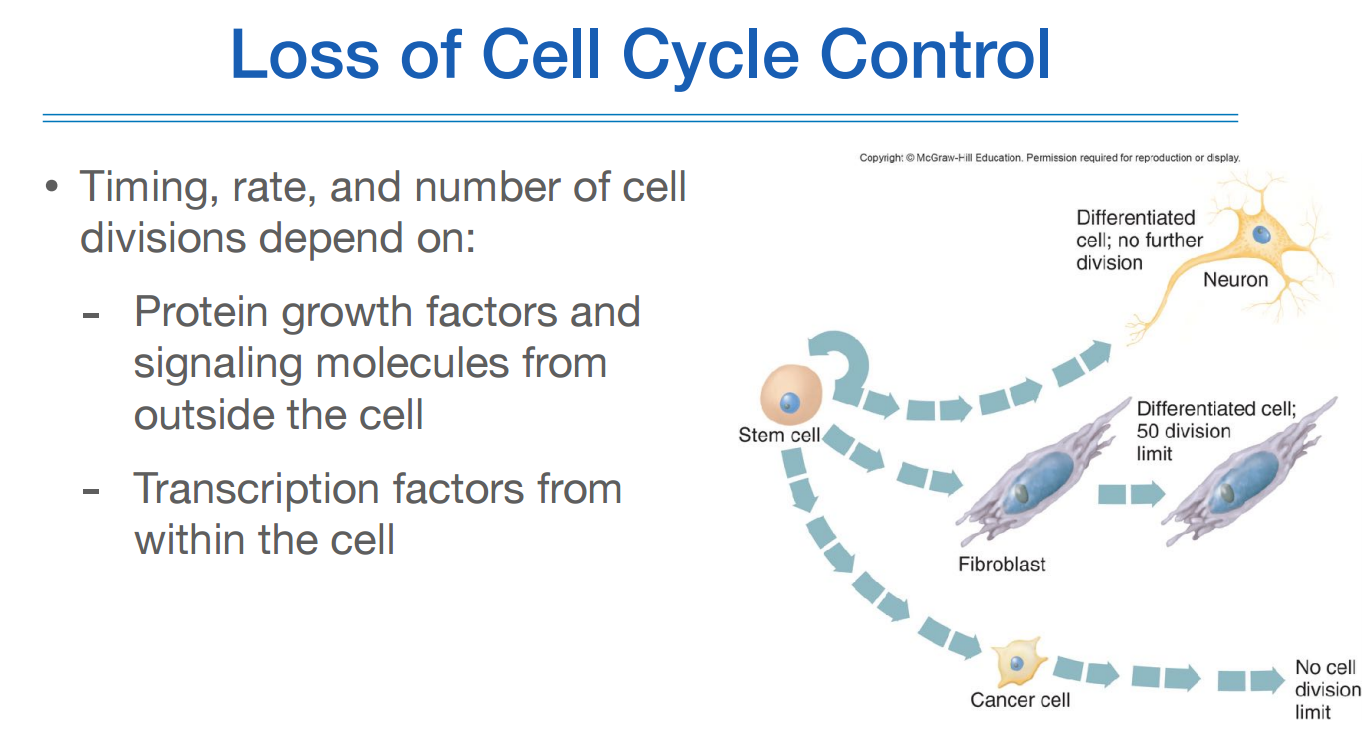
이런 셀 사이클은 여러 요인의 영향을 받는다.
셀 밖에 있는 growth factor나 sinaling molecule의 영향을 받거나, 혹은 셀 안에 있는 transcription factor에 영향을 받는다.
모든 세포는 stem cell에서 시작하여 뉴런 세포, 섬유아세포(fibroblast) 등으로 분화된다.
뉴런 세포의 특징은 뉴런세포가 되고 나서 더이상 분열을 하지 않는다. 셀 사이클이 끝나는 것이다.
섬유아세포같은 경우는 분화가 되고 나서도 50번 정도 분열되고는 더이상 되지 않는다.
cancer cell은 제한이 없다는것이 문제.
이런 분열과정에서 limit number, timing, rate 등을 세포 내외에 있는 genetic 인자들이 관여한다.

셀 사이클과 관련해서 제일 처음 나오는 유전적 개념은 텔로미어다.
염색체의 중간인 센트로미어에서 가장 먼 양쪽 끝부분을 의미한다.
텔로미어는 염색체 끝을 보호하는 역할을 하면서 분열, 분화가 되면서 텔로미어의 길이가 짧아진다.
그래서 뉴런셀같은 경우는 텔로미어의 길이가 매우 짧다.
반면 생식세포의 텔로미어는 길다.
텔로미어의 길이를 유지하는 역할을 하는 것이 텔로머레이즈이다.
뉴런셀 같은 경우는 텔로머레이즈가 역할을 안하고 있다.
cancer cell은 불이 꺼진 텔로머레이즈를 켜는 역할을 하여, 계속해서 분열하게 만든다.
텔로머레이즈를 인코딩하는 유전자가 TERT라는 유전자인데, 이 유전자의 변이가 생기면 이런일이 발생한다.

모순적인 문장이 있는데, cancer는 유적적이지만 inherited하지 않다. 라는 문장이다.
이 뜻은 다음 세대로 전달이 되지 않더라도 DNA 자체에서 변이가 생기는 것이기 때문에 genetic한 것이다 라는 뜻이다.
DNA가 증폭, 복제, 체크, 처리 되는 과정에서 변이가 생긴다는 것은 이 과정에 관여하는 유전자들에 대한 변이가 있다는 것이고 이것 자체가 유전적인 요인이라는 것이다.
뮤테이션을 germline과 somatic 요인 두가지로 본다면, cancer가 나타나려면 mutation이 두번 일어나야한다는 것이다.
위 그림에서 본다면 cancer가 일어나려면 빗금이 두번 쳐져서 체크무늬가 되어야하는데, germline은 부모부터 유전을 받아서 빗금이 한번 쳐진 상태인 것이다. 이 상태에서 흡연을 한다는 등 somatic한 영향으로 변이가 생긴다면 그때야 비로소 암에 생긴다는 것.
하지만 유전이 되는 경우는 전체 인구의 5%정도 밖에 되지 않는다. 이런 경우는 어린나이에 cancer에 걸리는 경우가 많다.
그것보다 더 많은 경우는 다른 외부적인 요인 두가지로 인해 체크무늬가 생긴다는 것.

cancer cell의 특징은 우선 생긴 것부터 정상적인 세포와 다르다.
또한 자기들끼리 모여서 생존하는 경우가 많고 항원(antigen)이 보통 세포보다 적다.
체세포 분열 중 heritable mutation은 변이가 된 딸세포가 다음 세대로 계속해서 변이가 되면서 변이된 세포가 증식한다는 것이다. 또한 암 세포를 다른 세포에 심으면 증식하는 이식성도 있다.
중요한 특징은 분화가 덜 되었다는(dedifferentiated) 점이다. 이런 애매한 상태에서 비정상적으로 증식이 되는 것이다.
침투적이며 전이가 되는 특징은 앞서 언급하였다.
또 중요한 특징은 angiogenesis인데, 혈관을 만들수 있다는 것이다. 세포가 살아가기 위해서 영양분을 공급 받아야하는데 이를 위해 cancer를 스스로 혈관을 만들어서 모체의 모세혈관 등까지 뻗어 영양분을 공급받는다.
Aneuploid라고 하는것은 정상적인 염색체수보다 많거나 적은 상태를 의미한다.
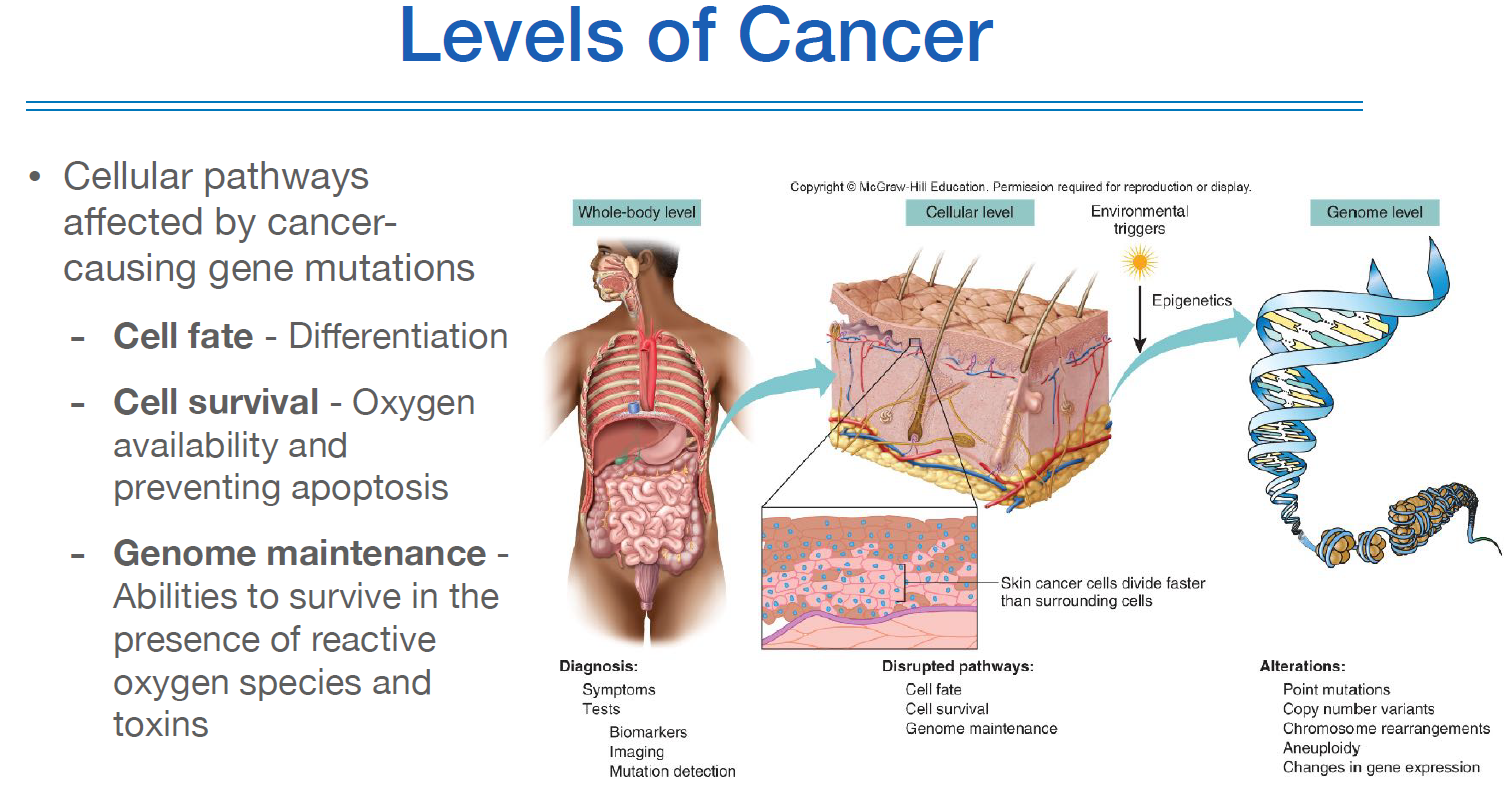
보통은 cancer를 celluler level과 genome level로 나누는데, 현재 앞단 celluler level에서 먼저 설명하는 이유는 celluler level에서 genetic 이팩트를 받기 때문이다.
genetic effect를 받는 celluler pathways는 위와 같이 크게 3가지가 있다.
cell fate는 분화가 덜 되었다는 것이고,
cell survival로 angiogenesis나 비정상적인 셀이 사멸하거나 수정되는 등의 처리가 안된다는 점이다.
genome maintenance는 정상세포라면 죽었을 환경에서 변이된 세포는 살아갈 수 있다는 특징이 있다.

암 세포의 시작은 모든 세포의 근원인 stem cell 에서 시작한다.
암 세포의 기원은 여러가지가 있는데, 그 중 한가지는 분화가 완료된 세포가 다시 stem cell로 넘어가려는 역분화 현상이 발생한다는 것이다. 그렇게 되면 비정상적인 세포를 계속해서 만들어가기 때문에 문제가 발생한다. 이를 cancer stem cell이라고도 부른다.
한편, 어떤 조직에서는 5%정도의 stem cell이 있는데, 그 비율이 증가하게 되면 분화를 갖춘 세포가 되게 된다.
또한 조직이 손상되었을때 수리하는 과정에서 지나치게 stem cell에 과부하가 오게 되면 문제가 생기는 경우도 있다.

이제 셀 단위가 아니라 유전자 level로 넘어오게 되면, driver mutation과 passenger mutation이 있다.
실제 cancer를 만들어내는 causal mutation을 driver mutation이라고 하고, 그에 따라오는 mutation이 passenger이다.
passenger mutation은 그냥 cancer cell 에서 발견이 되나, cancer가 되고 나면 다른 mutation들이 많이 생기는데 이것들이 이에 해당한다.
그래서 이 driver mutation을 잘 찾아야하는데 2020년까지 발견된 것은 500개 정도 된다.

cancer-causing gene이 driver mutation인데, oncogenes은 이 유전자에 mutation이 돼서 activation이 되면 cancer가 생기는 유전자이다. tumor suppressor gene은 이 유전자에 변이가 생겨 inactivation이 되면 cancer가 되는 유전자이다.
보통 oncogene은 도미넌트하고 tumor suppressor gene은 recessive effect이다.
또한 repair gene에 변이가 생기면 cancer가 생긴다.
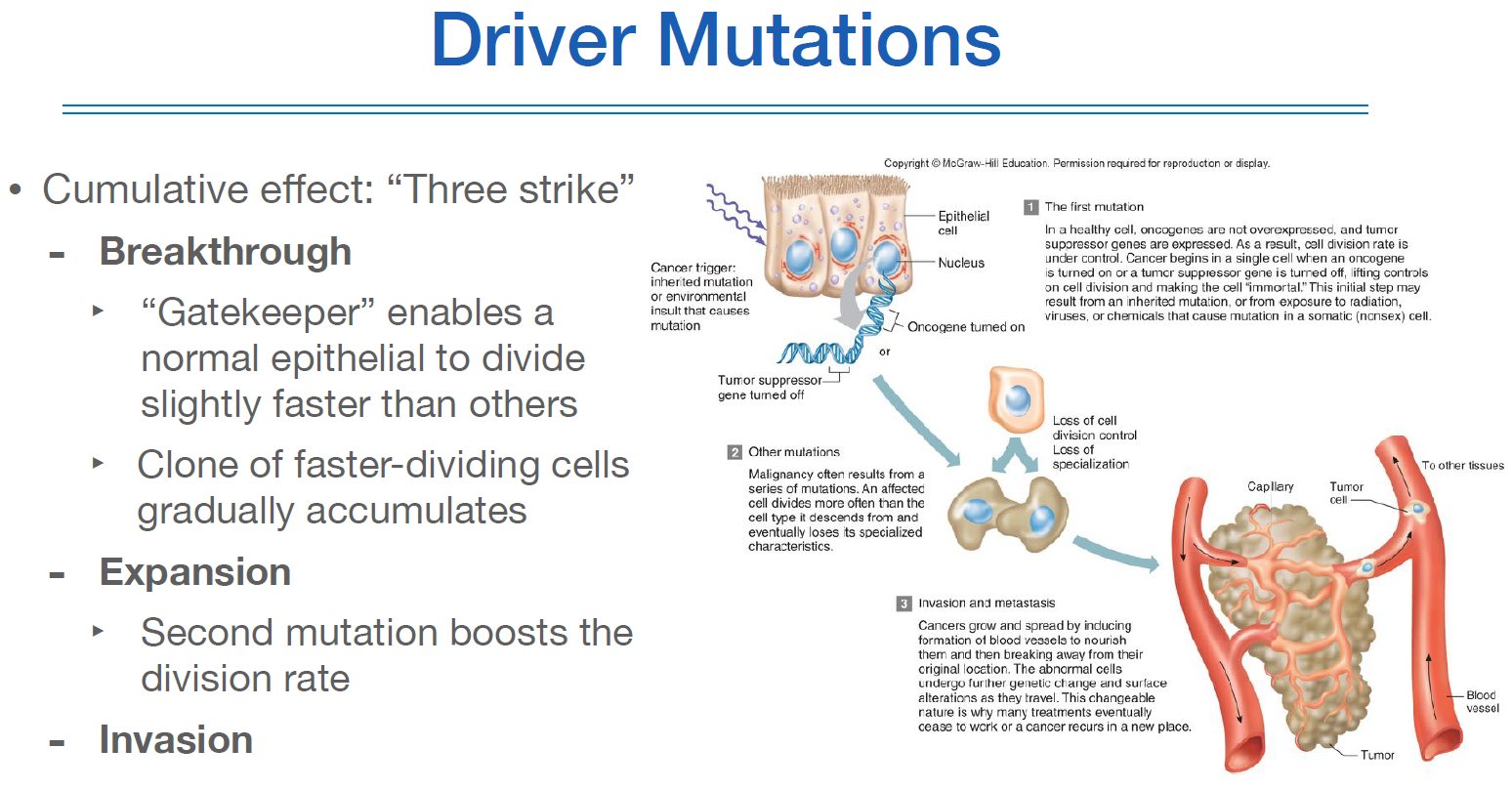
driver mutation은 3번에 걸쳐서 누적이 되면 cancer가 된다. 그래서 three strike.
첫번째 breakthrough는 분화속도가 약간 빨라지게 된 상태이다.
두번째 expansion은 엄청 빨리 분화가 되고, specialized 되는 상태를 잃게 된다. 이 상태에서 계속 분화가 된다.
세번째 invasion은 이제 세포가 스스로 혈관을 만들어나가면서 침투하는 단계이다.
여기까지 되어야 cancer가 된다.

위 그림은 여러 cancer의 각 단계에 관여하는 유전자에 대한 것이다. 이런 유전자에 변이가 생기면 각 단계가 일어날 수 있다. 그래서 암 환자의 유전자 조사를 해보면 나오는 암 기수마다 저렇게 나오는 유전자가 다르다.
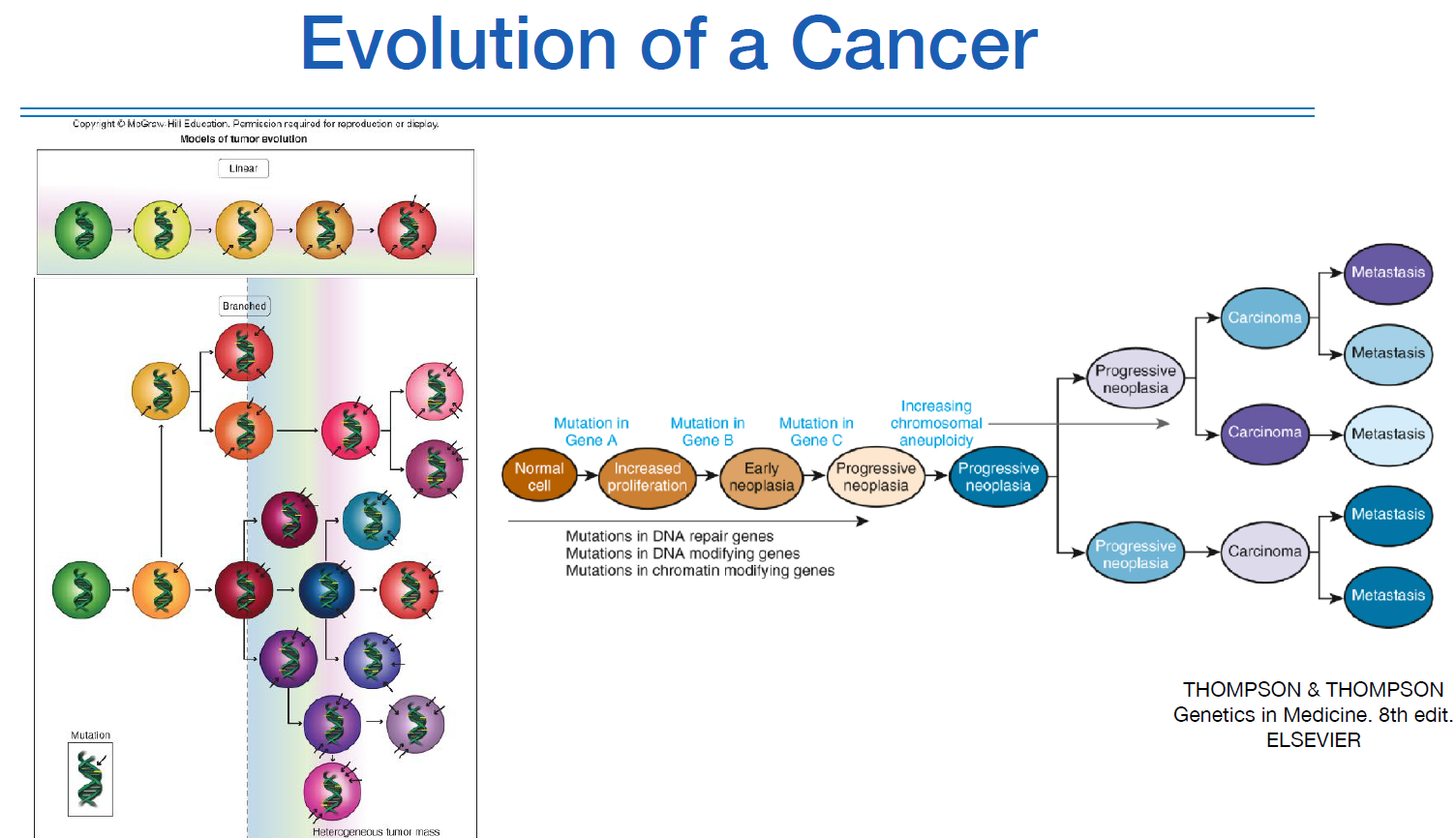
암의 진화는 위 그림처럼 linear하게 나타나지는 않고, 진화를 하면서 생물학적으로 조금씩 다른 형태로 분화된다.
이런 과정에서도 계속해서 또다른 mutation이 일어나기 때문이다.
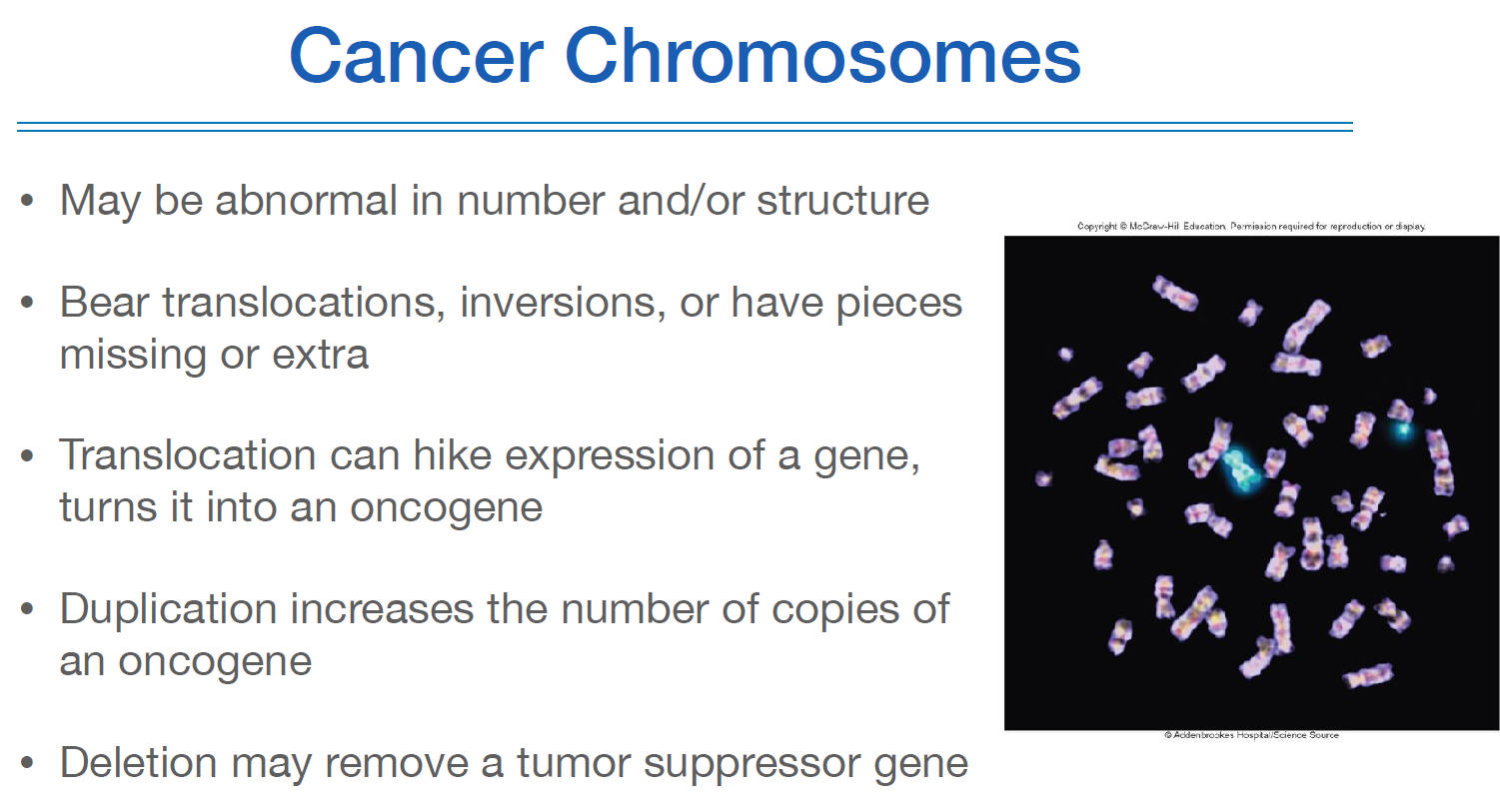
oncogene이 duplication이 되면 더 많은 tumor가 발생하고, tumor suppressor gene이 deletion이 되면 또한 tumor가 많이 발생하게 된다.
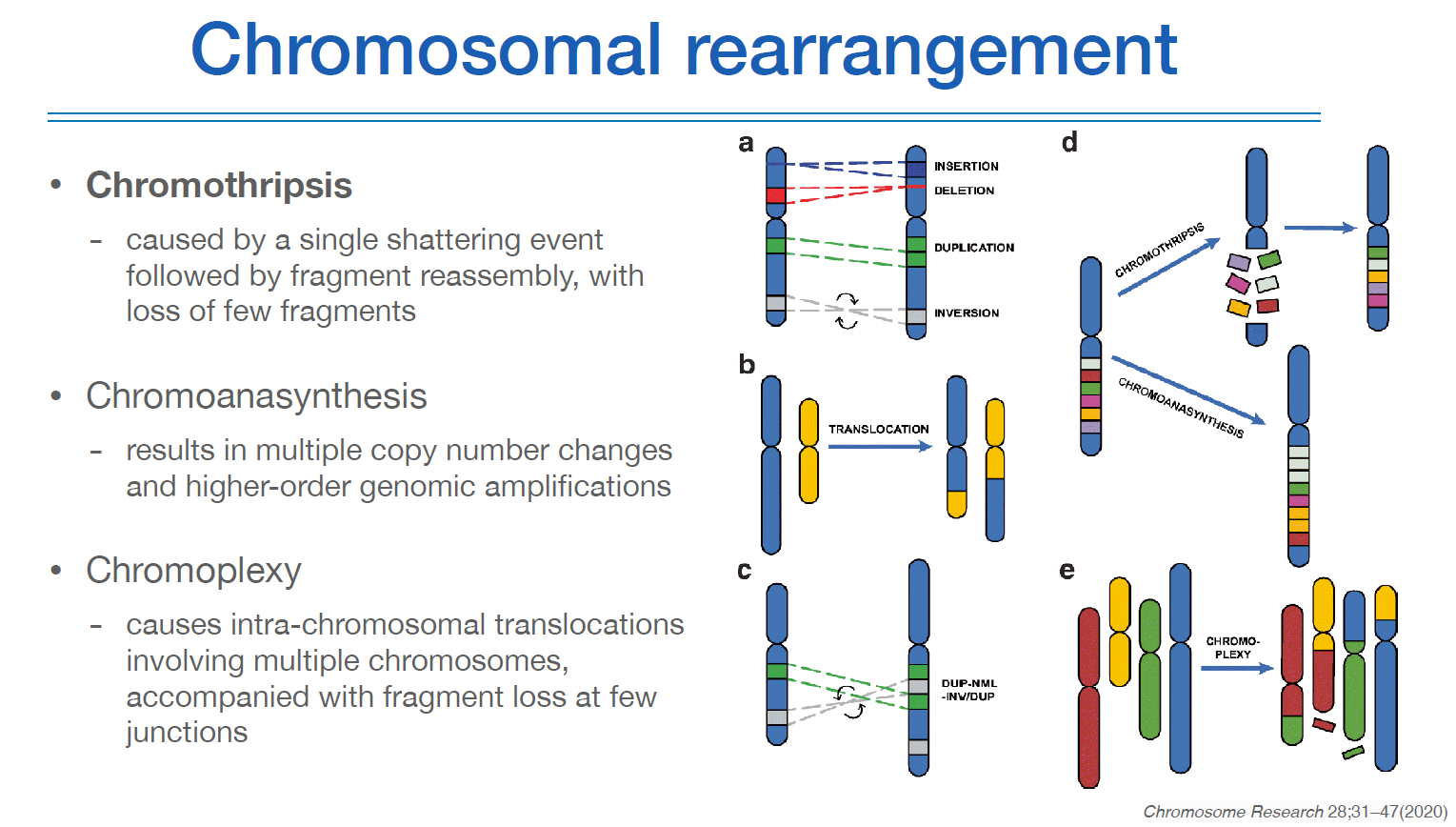
염색체 rearrangement는 염색체가 여러가지 패턴으로 모양이 바뀌는 것을 의미하고, 많은 cancer가 이런 상황에서 생긴다.
Chromothripsis는 어떤 이유에서든 염색체가 다 깨지는 상태가 된 것이다. 산산히 부숴진 상태에서 다시 붙게되면 정상적으로 짜맞춰지지 않아서 d처럼 된다. 보통 암은 뮤테이션의 누적으로 발생된다고 알려져있었는데, 최근에는 단 한번의 어떤 이벤트로도 암이 될 수 있다는 기전이 발견되어 연구가 진행되고 있다.
chromoanasynthesis는 자체적으로 copy가 발생하는 것이다.
chromoplexy는 다른 염색체와의 섞여버리는 상태이고, 가장 심각한 상태이다.

proto-oncogene은 셀 분열을 많이 하게 하는 유전자이다.
염색체의 rearrangement와 같은 경우들이 oncogene은 proto-oncogene으로 만들어내는 요인이 된다.
oncogene이 mutation이 되면 gain of function을 유발한다. 이름 그대로 어떤 기능을 획득한다는 말인데, 이 말은 양적인 의미가 될수도 있고, 기능적인 의미가 될 수 도 있다.
oncogene은 도미넌트 이팩트이다. 위 그림의 우측처럼 두 allele 중 하나만 일어나도 oncogene이 되는 역할을 얻게 된다.
좌측은 tumor surpressor gene이다. recessive하게 두 allele 모두 mutation이 되어야 일어난다.

proto-oncogene이 그럼 어떻게 activation되어서 oncogene이 되느냐 하면, 매우 active하게 transcription되는 유전자 옆에 위치하게 되면 된다. 예를 들어 viral gene이 proto-oncogene 옆에 inserting하게 되면 분열할때 transcription을 같이 하게 된다. 또한 호르몬을 만드는 유전자도 transcription이 높다고 알려져 있는데, 이 옆에 proto-oncogene이 붙게되면 같이 transcription이 많이 되어서 oncogene이 된다. antibody 유전자도 마찬가지이다.
원래 이런것들 옆에 proto-oncogene이 있었던 것이 아니고 앞서 본것처럼 다양한 카시노젠에 의해서 염색체 재정렬이 일어나는 상황에서 이러한 것들 옆으로 붙게 되는 것이다. proto-oncogene은 oncogene이 아니지만 이러한 상황에서 activation이 되면 oncogene이 되는 것이다.
바이러스 유전자는 늘 있던 것이 아니고 갑자기 신체에 들어온 것이다. 따라서 바이러스로도 암이 생길 수 있는데 대표적인 것이 HIV도 있지만 HPV, 자궁경부암 같은 경우에도 이런 기전이다.
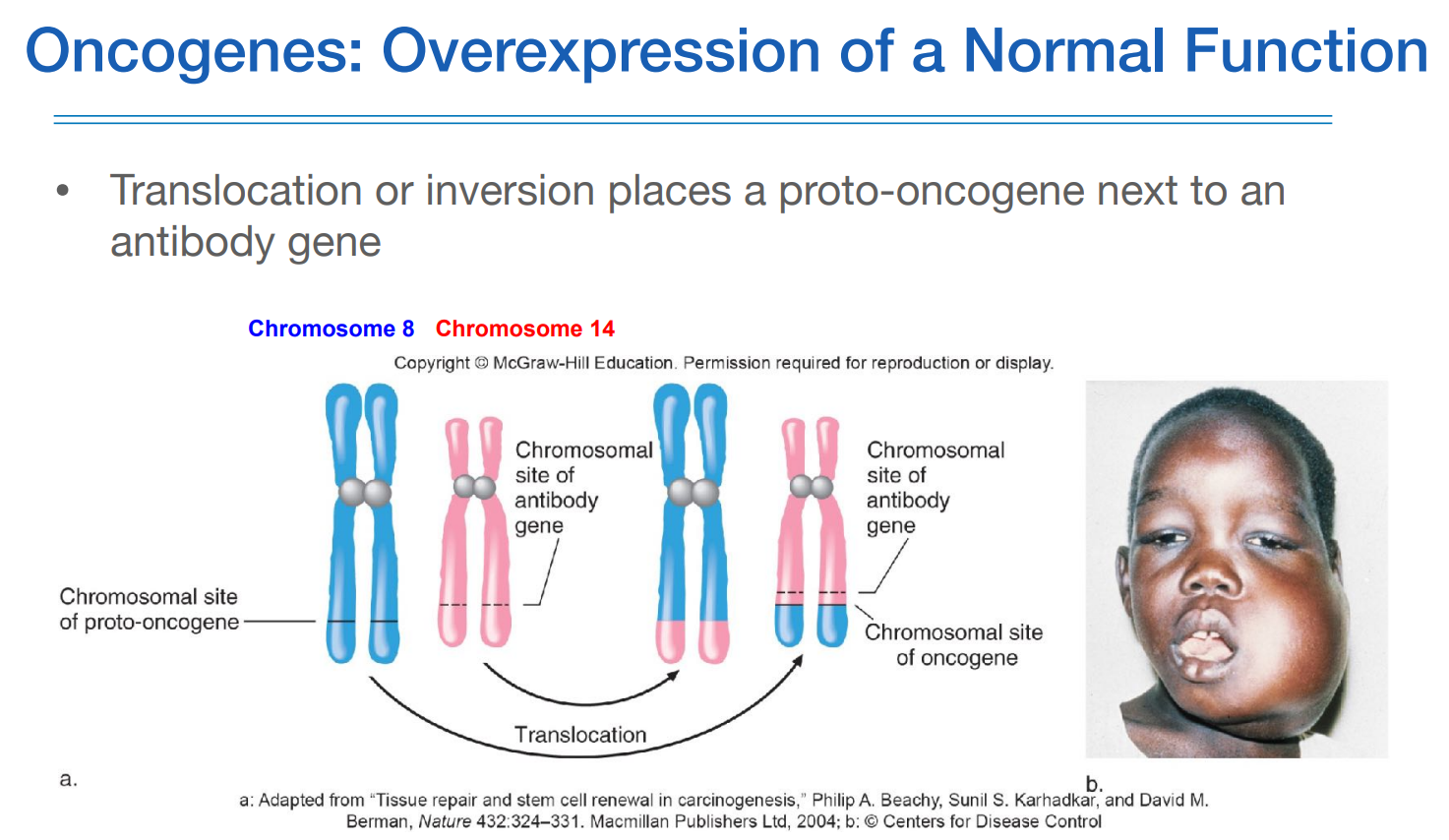
위 그림처럼 antibody 유전자 옆에 어떤 이유에서든 proto-oncogene이 붙게되면 antibody 유전자가 transcription을 많이 할때 같이 하게 되어 cancer가 생기게 되는 것이다.
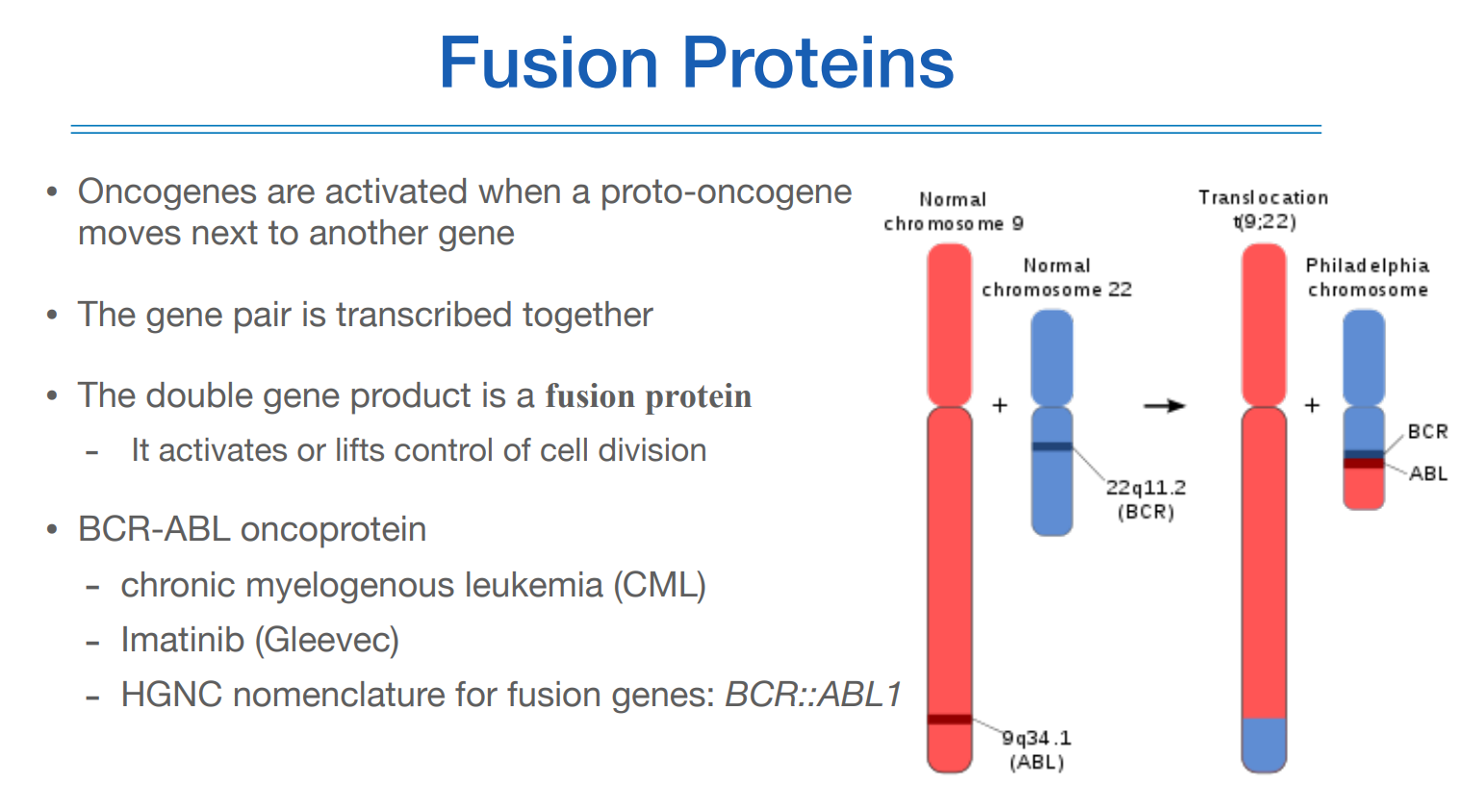
그 연장선상에서 fusion gene이라는 것이 있는데, 이게 뭐냐면,
두 유전자가 translocation에 의해 위 그림처럼 붙게 되면, 두 유전자는 서로 아무 상관도 없었는데 붙으면서 마치 하나의 유전자처럼 RNA와 protein을 만든다. 그렇게 되면 원래 가지고 있던 기능과는 다른 기능을 하게 되면서 cell division control을 제대로 할 수 없게 되는 등 문제가 발생한다.
이 BCR-ABL이 대표적인 예시인데 이걸 발견함으로 인해서 표적항암제라는 치료의 시발점이 되었기 때문이다.
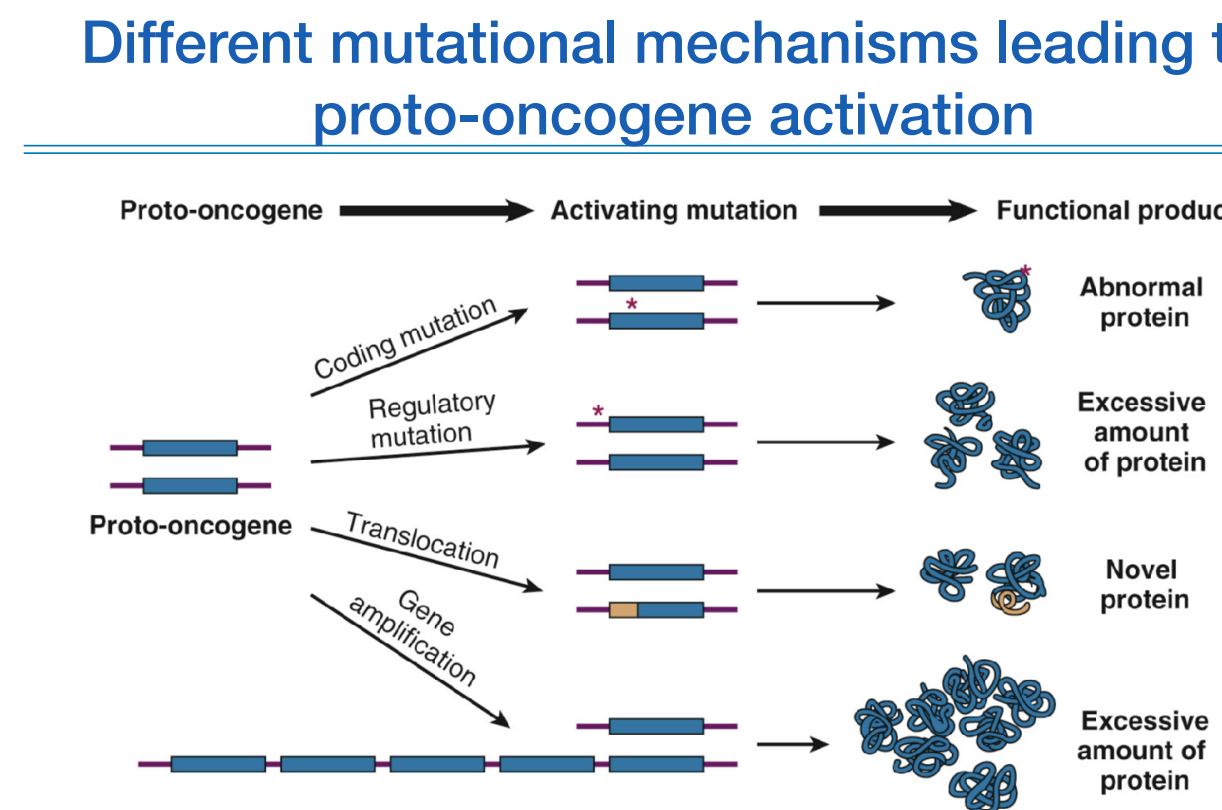
위 그림처럼 proto-oncogene에 다양한 변이로 의해 다양한 functional product가 만들어진다.

tumor suppressor gene은 앞에 설명드린대로 어떤 activation을 억제하는 역할을 하는 유전자이다.
RB라는 암 케이스를 발견함으로써 tumor suppressor gene을 알게되었는데, RB 유전자가 셀 사이클 중 G1 단계에서 문제가 생겼을때 중지시키는 역할을 하는데, 이를 하지 못함으로 문제가 발생하는 것이다.
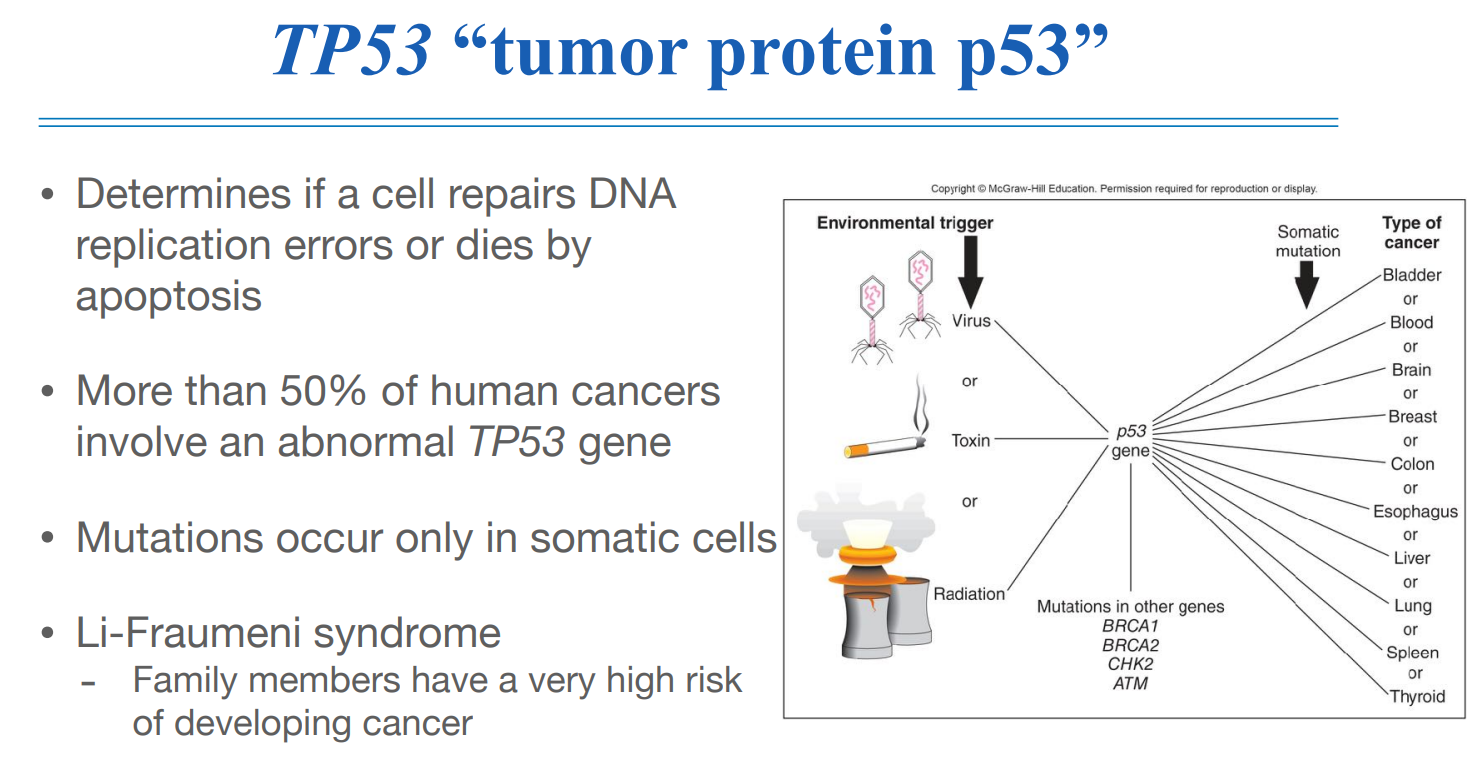
대표적인 tumor suppressor gene으로는 tp53이 있는데, 이 친구의 역할은 DNA replication 에러가 있는지 확인하고 처리하는 역할을 한다.
위 그림에서 처럼 다양한 카시노젠이 암으로 나타나게 되는 중간 매개과정으로 tp53이 역할을 하게 된다고 알려져 있다.
tp53은 다른 driver mutation과도 연관이 있어서 다양한 질환에 관여를 하고 있다.

그렇다면 어떻게 유전자 검사로 진단과 치료에 활용을 할 수 있느냐.
기존에 암을 진단할때는 증상이 나와야만 조직검사 등 병리학적으로 봤을때 알 수 있었지만, 요즘에는 피검사를 통해 특정 cancer에서 많이 만들어지는 protein 등과 같은 biomarker을 이용해 검진 시 스크리닝 테스트를 할 수 있다.
좀 더 발전해서 알려진 oncogene, tumor supressor gene, driver mutation 등을 chip array처럼 한 패널로 짜서 확인하기도 한다.
치료에서 가장 많이 사용하고 강력한 방법은 조직 자체를 없애는 방법이 있다.
방사능 치료나 화학적 치료로 암 세포를 죽이거나 기능을 못하게 하는 방법도 있지만, 단점은 암세포 뿐만 아니라 정상세포도 죽이기 때문에 머리카락이 빠지는 등 사이드 이팩트가 있다.
발전된 방법은 표적항암제를 이용해 치료하기도 한다. 해당 암을 유발하는 gene이 발견된 경우에만 보통 가능하지만.
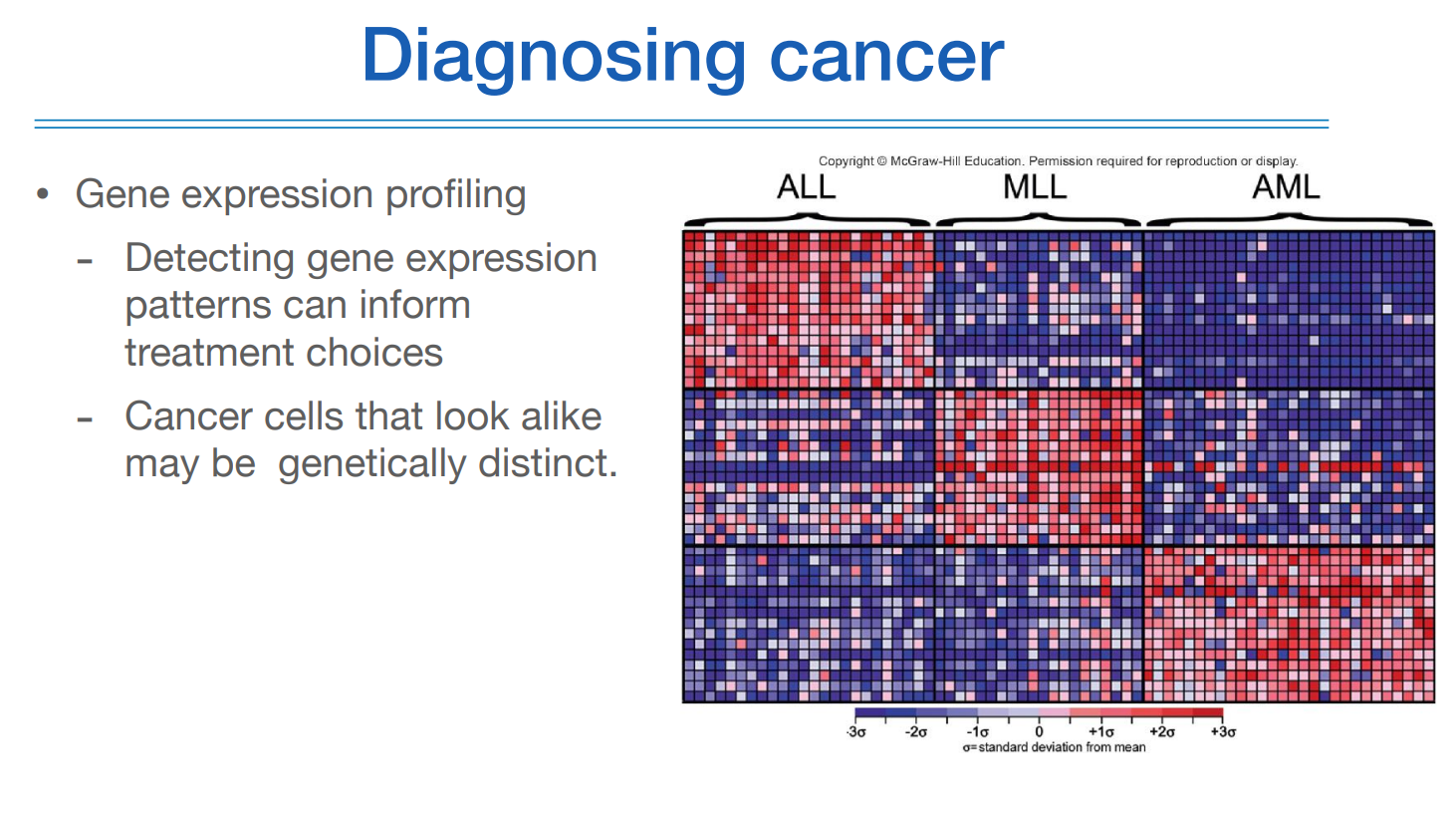
암 진단은 유전자 발현 프로파일링으로 할 수 있다.
위 그림은 예전에는 증상이나 임상적으로 동일한 줄 알았던 백혈병(ALL, MLL, AML) 환자에서 알고보니 특정 gene에 대해서 각기 다른 패턴의 expression이 보여짐으로 인해서 같은 그룹이 아니라는 것을 알 수 있었다.
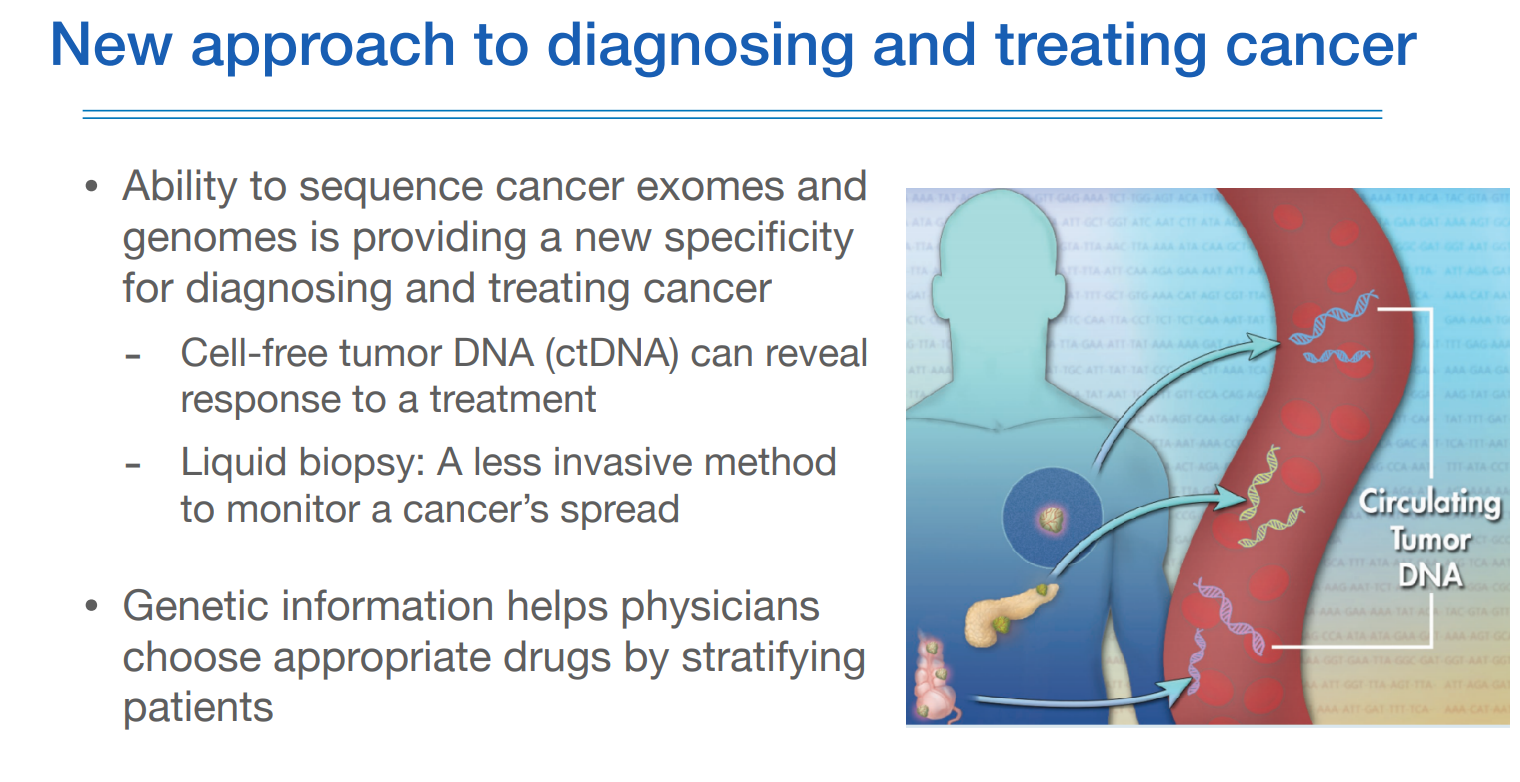
진단과 치료에 또한 소개되는 것은 circulating tumor DNA이다.
정상적인 세포가 깨져서 DNA 자체가 혈액이나 소변에 떠다니는 경우가 있다. (원래 핵 안에 있어야하는데 핵도 없는 상태에서)
그리하여 조직검사를 하지 않아도 피검사 만으로도 cancer DNA를 확인할 수 있고, 이런 DNA를 cell free DNA라 하여 ctDNA라고도 한다.
암 환자의 수술 후 완치가 되었어도 모니터링하는데에 검사로도 활용한다.
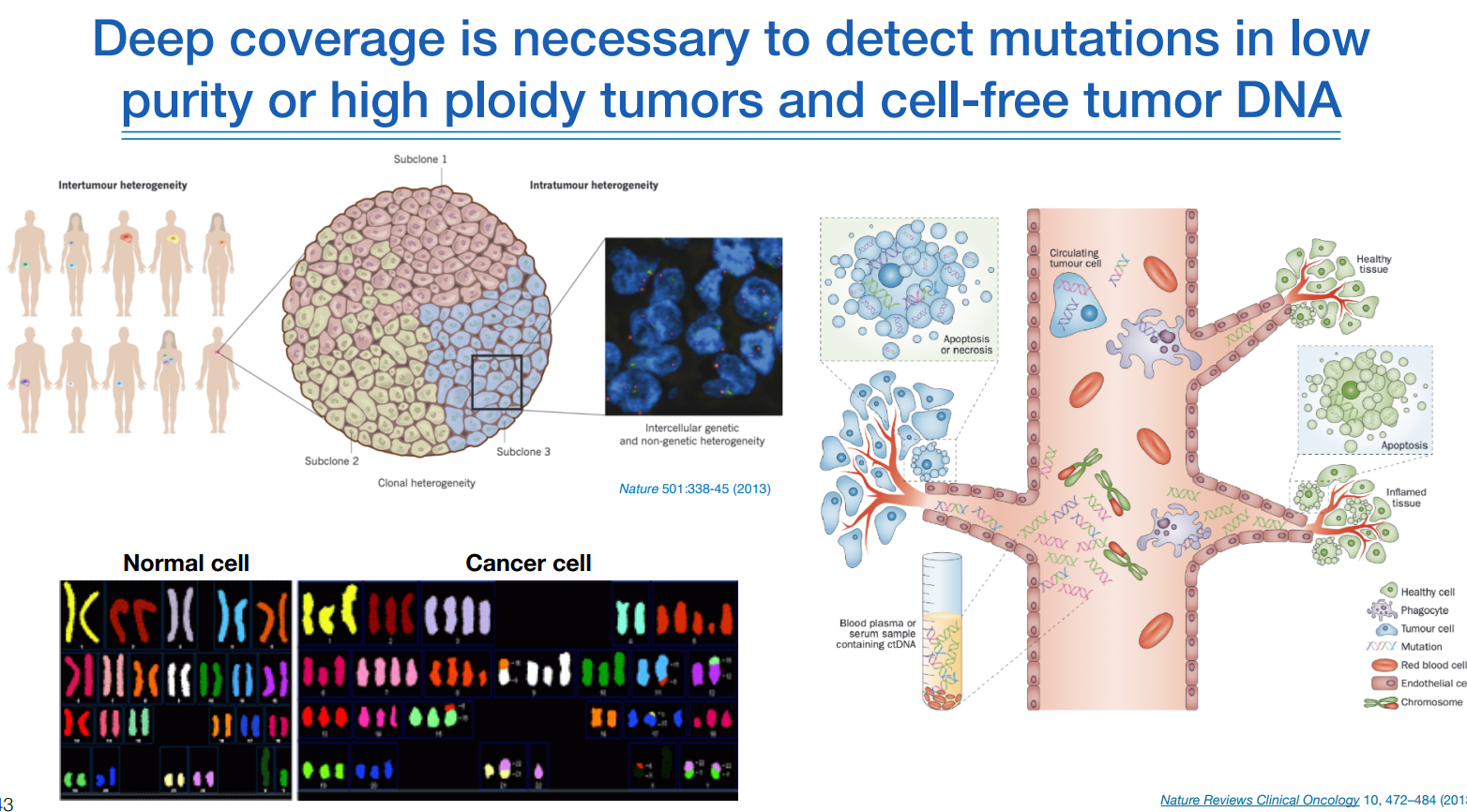
이 암 유전학이 어려운 이유는 같은 종양인데도 다 다양하고, 종류별로 mutation이 각기 다르다.
혈액 검사를 할지라도 혈액 안에 있는 우리가 원하는 암 DNA는 극히 소량이다. 그렇기 때문에 high depth으로 시퀀싱을 해야하며, 그럼에도 어렵기 때문에 보통 single cell 단위로 암 유전학 연구가 많이 진행이 된다.
single cell 분석에서는 DNA 레벨보다는 RNA 레벨에서의 expression 연구가 많다.
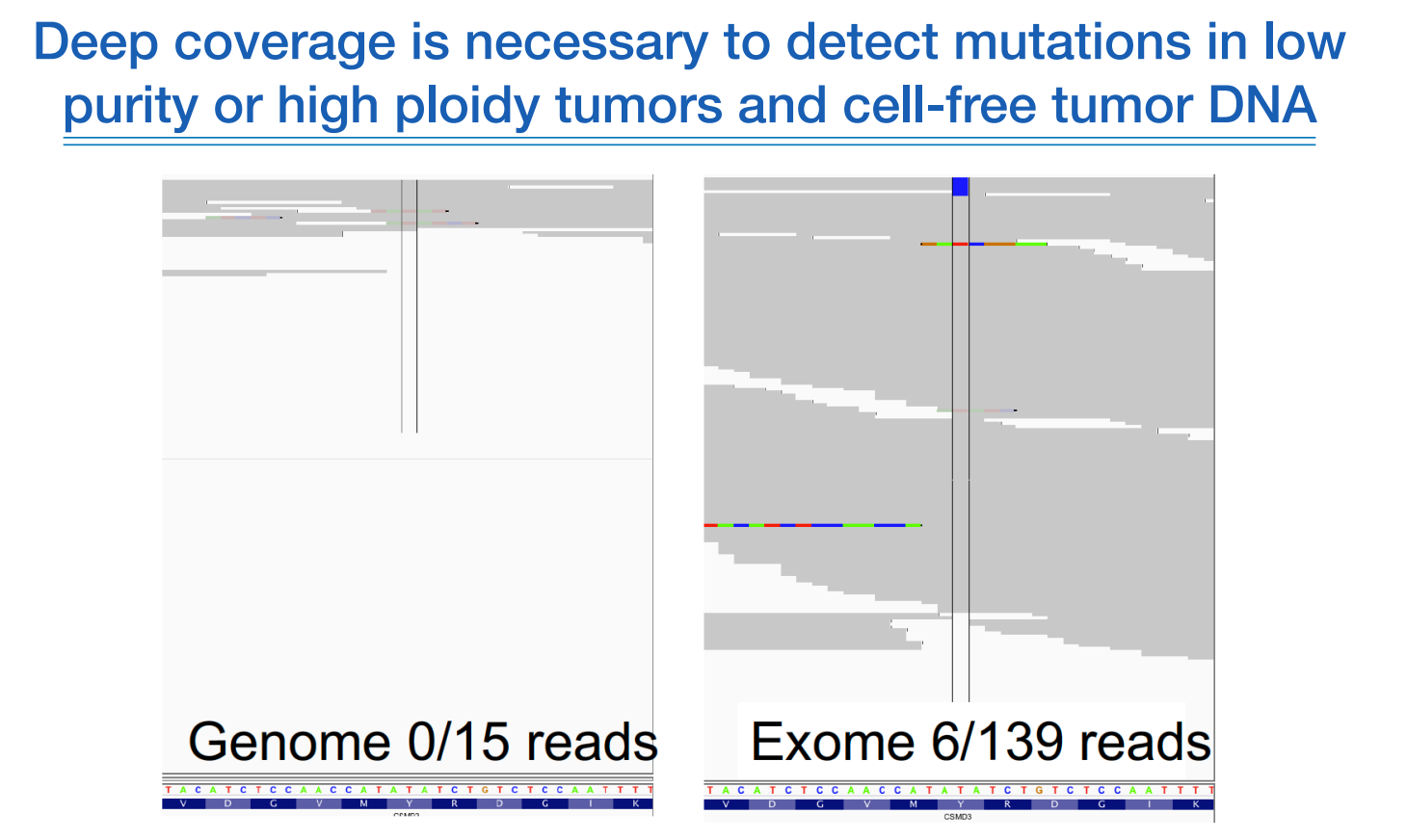
위 그림의 좌측처럼 low depth로 하면 발견하지 못하지만, 우측처럼 high depth로 하면 변이가 보이게 된다.
위와 같은 비율로 germline에서 나타나면 에러지만, 암 연구에서는 우리가 찾고 싶었던 바로 그 변이이다.
끝! 아 힘들다!!
'medical' 카테고리의 다른 글
| [medical] 유전역학-9주차, 유전체 데이터의 해석과 질병 위혐률 예측 (0) | 2023.05.01 |
|---|---|
| [medical] 유전역학-개론 7주차, 유전자 변이에 대한 명명법 (0) | 2023.04.19 |
| [medical] 유전역학-개론 6주차, 차세대 시퀀싱(NGS) 데이터 분석 (1) | 2023.04.12 |
| [medical] 유전역학-개론 5주차, 유전체 시퀀싱 기술 (2) | 2023.04.05 |
| [medical] 유전역학-개론 4주차, 전장유전체 연관분석(GWAS) (2) | 2023.03.28 |




